产品注册
1.1 法规背景
《中华人民共和国药品管理法》《药品注册管理办法》
总局关于调整原料药、药用辅料和药包材审评审批事项的公告(2017年第146号)
国家药监局关于进一步完善药品关联审评审批和监管工作有关事宜的公告(2019年 第56号)
1.2 注册范围
在中华人民共和国境内研制、生产、进口和使用的原料药、药用辅料、药包材。
1.3 注册主体
中华人民共和国境内外原料药、药用辅料、药包材的生产厂家。
1.4 注册分类及流程
原料药登记、更新、年度报告;
药用辅料登记、更新、年度报告;
药包材登记、更新、年度报告。

1.5 上市后责任/监管
1) 登记资料更新,包括重大变更、中等变更、微小变更及基础信息变更;
2) 年度报告资料提交。
1.6 佰药服务内容
我们提供DMF申请相关的各种法规咨询。请联系我们以获取有关以下服务的更多信息:
1)注册申请和登记备案的代理服务;
2)提供申请材料清单和数据差距分析,文件翻译以及卷宗准备指南;
3)提供定制的档案分析以及风险评估和优化的注册策略,以避免应用档案中可能出现的缺陷并最大程度地减少失败风险;
4) 对于高风险产品,通过提供法规遵从性咨询并安排现场审核或模拟检查,协助NMPA进行样品测试和现场检查的准备工作;
5)提供DMF备案的全方位咨询服务,包括与CDE审查员进行技术合规沟通,回复CDE的邮件,准备和提交补充申请或变更申请;
6)扩大市场认可后产品备案的服务范围,包括准备,撰写和提交年度报告;
7)当地专家咨询技术转让。
2.1 法规背景
《中华人民共和国药品管理法》《中华人民共和国药品管理法实施条例》《药品注册管理办法》
2.2 注册范围
在中华人民共和国境内进口、销售和使用的仿制药。
2.3 注册主体
境内申请人应当是在中国境内合法登记并能独立承担相应法律责任的机构或人员,境外申请人应当是境外合法获得药品上市许可的厂商。
2.4 注册分类及流程
国产仿制药、进口仿制药。
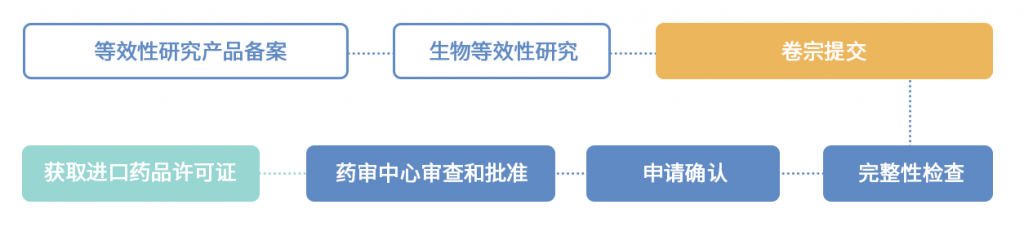
2.5 上市后责任/监管
1) 注册资料更新,包括重大变更、中等变更、微小变更及基础信息变更;
2) 年度报告资料提交。
2.6 佰药服务内容
我们提供药品注册相关的各种监管咨询。请联系我们以获取有关以下服务的更多信息:
1)注册申请和登记备案的代理服务;
2)提供申请材料清单和数据差距分析,文件翻译以及卷宗准备指南;
3)提供定制的档案分析以及风险评估和优化的注册策略,以避免应用档案中可能出现的缺陷并最大程度地减少失败风险;
4)协助与CDE审稿人和IND前会议进行沟通;
5)通过提供法规遵从性咨询并安排现场审核或模拟检查,协助NMPA准备样品测试和现场检查;
6)在开发,设计和实施的各个方面进行临床试验或生物等效性研究:提供实验设计和实施计划,协助在中国的临床研究组织(CRO)进行搜索,提供对CRO的评估和尽职调查;
7)提供临床试验的文件翻译,包括药理和毒理学文件,参考期刊文章等;
8)药品注册之前的全程咨询服务,包括与CDE审查员进行技术合规性沟通,回复缺陷邮件,准备和提交补充申请或变更申请;
9)药品注册批准后的服务,如准备,撰写和提交年度报告等。
3.1 法规背景
《中华人民共和国药品管理法》《中华人民共和国药品管理法实施条例》《药品注册管理办法》关于调整药物临床试验审评审批程序的公告(2018年第50号)
3.2 登记范围
在中华人民共和国境内申报药物临床试验的登记申请。
3.3 登记主体
临床登记申请人应当是合法登记并能独立承担相应法律责任的机构。
3.4 登记分类及流程
创新药的临床登记、改良型创新药的临床登记。
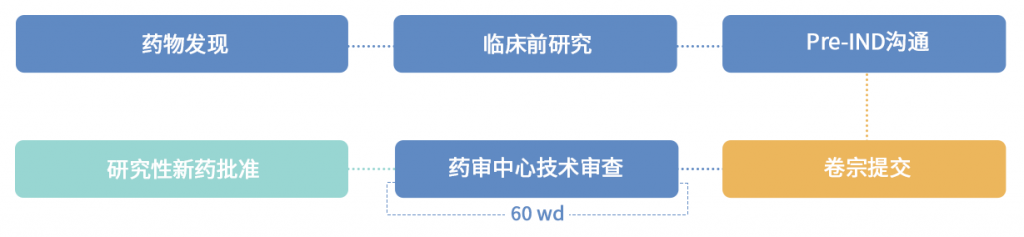
3.5 佰药服务内容
1) Pre-IND沟通会议的申请服务;
2) IND申请可行性或差距评估,预估风险,避免后期因法规和政策原因导致登记申请失败;
3) 提供IND申请编写大纲;
4) CTD格式IND申报资料的审核、翻译、完善、编写、递交(包括eCTD格式的转化和编写);
5) 注册检验送样、申请、跟踪和问题解决;
6) IND注册登记全程跟踪,包括CDE发补回复的方案制定及补充回复资料的撰写、递交。
4.1 法规背景
《中华人民共和国药品管理法》《中华人民共和国药品管理法实施条例》《药品注册管理办法》
4.2 注册范围
在中华人民共和国境内申报药物上市的注册申请。
4.3 注册主体
药品上市申请人应当是合法登记并能独立承担相应法律责任的机构。
4.4 注册分类及流程
创新药的上市注册、改良型创新药的上市注册。
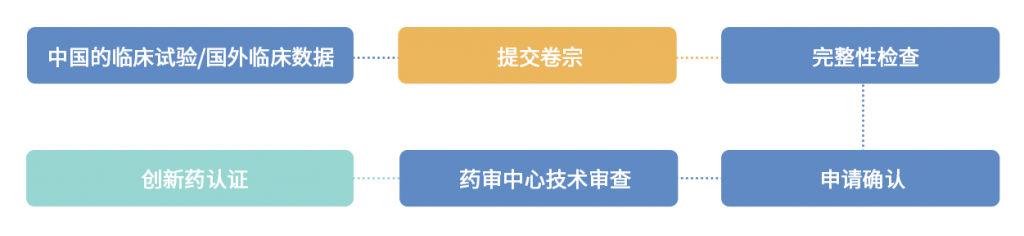
4.5 上市后责任/监管
1) 注册资料更新,包括重大变更、中等变更、微小变更及基础信息变更;
2) 年度报告资料提交。
4.6 佰药服务内容
1) NDA注册可行性或差距评估,预估风险,避免后期因法规和政策原因导致注册申请失败;
2) 提供NDA注册申请的编写大纲;
3) CTD格式NDA申报资料的审核、翻译、完善、编写、递交(包括eCTD格式的转化和编写);
4) NDA注册申报全程跟踪,包括CDE发补回复的方案制定及补充回复资料的撰写、递交;
5) 获批上市后的各类变更提交服务;
6) 获批上市后的产品年报编写和提交服务。
